硫酸バリウムの沈殿の量から、中和する水酸化バリウムの量を計算で求める(2017年三重)
硫酸と水酸化バリウムの反応
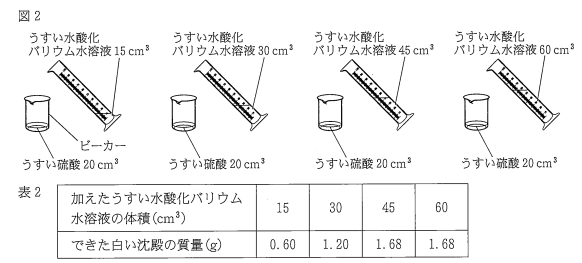
4つのビーカーに同じ濃度のうすい硫酸を 20 cm³ずつとり、図2のように,それぞれの ビーカーにうすい水酸化バリウム水溶液を 15 cm³, 30 cm³, 45 cm³, 60 cm³加えた。このと き、すべてのビーカー内に白い沈殿ができ、できた白い沈殿をそれぞれじゅうぶんに乾燥させ て質量を測定した。表2は,加えたうすい水酸化バリウム水溶液の体積とできた白い沈殿の質 量をまとめたものである。なお,加えたうすい水酸化バリウム水溶液はすべて同じ濃度である。
沈殿の量が増えないのはなぜか?
(a) うすい水酸化バリウム水溶液の中で,水酸化バリウムは水酸化物イオンとバリウムイオンに電離している。加えるうすい水酸化バリウム水溶液の体積を 45 cm³ から 60 cm³に増やし ても、できた白い沈殿の質量が変わらなかったのはなぜかその理由を,白い沈殿ができる もとになる2種類のイオンの名称を使って,簡単に書きなさい。
硫酸20cm³に水酸化バリウムを加えると次の反応が起こる。
H₂SO₄+Ba(OH)₂→BaSO₄+2H₂O
このとき、沈殿のもとになるイオンは
SO₄²⁻とBa²⁺である。
Ba²⁺*SO₄²⁻→BaSO₄
の反応が起こって硫酸バリウムは水に溶けにくい物質なので沈殿する。
硫酸の中に含まれている 硫酸イオン が 水酸化バリウムの中のバリウムイオンとすべて反応して
バリウムイオンが反応する硫酸イオンがなくなったため
沈殿は増えない。
中性に必要な量
きよこさんは,表2から,うすい硫酸 20 cm³を中性にするために必要なうすい水酸化バ リウム水溶液の体積について考えた。中性にするために必要なうすい水酸化バリウム水溶液 は何cm³か,求めなさい。

表2をグラフにすると次のようになる。

グラフから右上がりの直線と一定の量になった時の直線が交わったところの水酸化バリウムの体積が求める量になる。

水酸化バリウム15cm³のとき、沈殿は0.60g
水酸化バリウムcm³のとき、沈殿は1.68g生じる。
15:0.60=1:0.04より
1:0.04=:1.68
0.04=1.68
=
=
=42cm³
ポイント
この沈殿の量に関するグラフは現在出題されていない。
しかし、炭酸水素ナトリウムと塩酸の反応における二酸化炭素の発生量
炭酸カルシウムと塩酸の反応における二酸化炭素の発生量
のように、右上がりの直線と一定になる直線になるグラフを書く問題のとき、一定になるときの量はいくらかというのがよく出題される。
炭酸水素ナトリウムと塩酸の反応を動画で解説