硫酸、塩酸と水酸化バリウムの反応
水溶液の性質を調べるため、うすい硫酸が40cm³入っているビーカーAとうすい塩酸が40cm³ 入っているビーカーBを2組用意し、うすい水酸化バリウム水溶液を用いて,次の実験を行った。
実験1
[1] 1組目のピーカーA,Bそれぞれに,BTB溶液を数滴加えたところ、いずれも水溶液は黄色になった。
[2] 図1のように, [1]のA, Bそれぞれに、うすい水酸化 酸化バリウム水溶液を少 しずつ加えた。Aは白い 沈殿が生じ、20cm³加えたところで水溶液が緑色 になったので,加えるのをやめた。Bは沈殿ができず,30cm³加えたところで水溶液が緑色になったので、加えるのをやめた。
[3] さらに,A,Bそれぞれに、うすい水酸化バリウム水溶液を10cm³加えると,いずれの水溶液も青色になった。
[4] Aのうすい硫酸が反応して生じた沈殿をすべて取り出し、質量をはかると0.5g であった。
BTB溶液の色の変化からわかること
(1) 次の文について,①②に当てはまる語句を,それぞれ書きなさい。
[1]において, ビーカーA,Bの水溶液がどちらも黄色になったことから,A,Bに共 通して含まれるイオンは①( )イオンと考えられる。
[2]において,A,Bの水溶液が それぞれ緑色に変化したとき、この①( )イオンと、加えたうすい水酸化バリウム水溶 液に含まれている②( )イオンとが,すべて結びついて水になったと考えられる。
Aの硫酸と水酸化バリウムとの反応を考える
H₂SO₄ + Ba(OH)₂ → BaSO₄ + 2H₂O
この反応は
H₂SO₄ →2H⁺ + SO₄²⁻
Ba(OH)₂ →Ba²⁺ + 2OH⁻
Ba²⁺ + SO₄²⁻ → BaSO₄
硫酸バリウムは沈殿する。
2H⁺ + 2OH⁻ → 2H₂O
水素イオンと水酸化物イオンは反応して水になる
化学反応式は簡単な整数比になるので
化学反応式では
H⁺ + OH⁻ → H₂O
水素イオン 水酸化物イオン 水
が起こっている。
Bの塩酸と水酸化バリウムの反応を考える
Hcl Ba(OH)₂ BaCL₂ H₂O
塩酸と水酸化バリウムの反応の係数を合わせ
( )HCl +( )Ba(OH)₂→( )BaCl₂+( )H₂O
反応前と反応後の原子の種類の表を作る
| ( )HCl | ( )Ba(OH)₂ | ( )BaCl₂ | ( )H₂O | |
| H | ||||
| Cl | ||||
| Ba | ||||
| O |
この表の中で最初はBa(OH)₂の係数を1として考える。
HClを1としたとき、右辺が分数になるので考えにくくなるので簡単になるように
Ba(OH)₂を1とする。
| ( )HCl | (1 )Ba(OH)₂ | ( )BaCl₂ | ( )H₂O | |
| H | 2 | |||
| Cl | ||||
| Ba | 1 | |||
| O | 2 |
Baは左辺と右辺に一つしかないとすると。右辺のBaCl₂の係数も1と決まる。
すると次の表ができる
| ( )HCl | (1 )Ba(OH)₂ | ( 1 )BaCl₂ | ( )H₂O | |
| H | 2 | |||
| Cl | 2 | |||
| Ba | 1 | 1 | ||
| O | 2 |
ここで右辺のClの数が2と決まったので左辺のClも2ときまる。
すると次の表ができて、HClの係数が2となる
| (2 )HCl | (1 )Ba(OH)₂ | ( 1 )BaCl₂ | ( )H₂O | |
| H | 2 | 2 | ||
| Cl | 2 | 2 | ||
| Ba | 1 | 1 | ||
| O | 2 |
すると、左辺のHの数が4個と決まるので右辺のH₂Oの係数は2となる。
| (2 )HCl | (1 )Ba(OH)₂ | ( 1 )BaCl₂ | ( 2 )H₂O | |
| H | 2 | 2 | 4 | |
| Cl | 2 | 2 | ||
| Ba | 1 | 1 | ||
| O | 2 | 2 |
これで、左辺と右辺の原子の種類と数が一致したので化学反応式を作る。
2Hcl+1Ba(OH)₂→1Ba(OH)₂+2H₂O
ここで1を省略して
2HCl+Ba(OH)₂→BaCl₂+2HCl
塩化物イオン バリウムイオン 塩化バリウム
2Cl ⁻+Ba²⁺ → BaCl₂
ここで、塩化バリウムは水に溶けるので沈殿は生じない
水素イオン 水酸化物イオン
2H⁺ + 2OH⁻ → 2H₂O
このように二つの反応を化学反応式にしてから問題を見る
[1]において, ビーカーA,Bの水溶液がどちらも黄色になったことから,A,Bに共 通して含まれるイオンは①( )イオンと考えられる。
[2]において,A,Bの水溶液が それぞれ緑色に変化したとき、この①( )イオンと、加えたうすい水酸化バリウム水溶 液に含まれている②( )イオンとが,すべて結びついて水になったと考えられる。
[1]はまだ何も反応させていないA硫酸 B塩酸にBTB溶液を加えたのだから、それで色が変わったのは水素イオンによって酸性を示したためである。
①は 水素
と入る。
BTB溶液が緑色になったということは。中性である。
中性のとき、反応溶液の中にはH⁺とOH⁻が余計にない状態である。
水酸化バリウム水溶液に含まれているのはBa²⁺ とOH⁻でBTB溶液の色を変える働きがあるのはOH⁻だから、
②水酸化物
が入る
①水素 イオン と②水酸化物 イオンが反応すると水になるので。
この文章は完成する。
フェノールフタレインを加えて反応を見る
(2) 次の文の①~③の空欄に当てはまるものを,それぞれア,イから選びなさい。
ビーカーBにおいて,BTB溶液の代わりにフェノールフタレイン溶液を用いて実験を 行った場合,うすい水酸化バリウム水溶液を加える量が①(ア 20cm³ イ30cm³}を 超えると②(ア無色 イ黄色)から③( ア赤色 イ青色)に変化すると考え られる。
ビーカーBは塩酸で始めは酸性で黄色だが、水酸化バリウムを30cm³加えたところで緑色になるということは、30cm³で中性になったということである。
フェノールフタレインは酸性、中性で無色、アルカリ性で赤くなる。
水酸化バリウムを30cm³加えるところまでは無色である。よって①イ
②ア ③ア
となる。
硫酸バリウムの質量の変化
(3) [4]について、ビーカーAに加えたうすい水酸化バリウム水溶液の体積と、生じた沈殿 の質量の関係を表したグラフとして,最も適当なものを,ア~カから選びなさい。

硫酸に水酸化バリウムを加えていくと水酸化バリウムが20cm³のときまで、SO₄²⁻の中の硫酸イオンと反応して硫酸バリウムが生じるが、20cm³を超えるとそれ以上の硫酸バリウムは生じない。
最大0.5gの沈殿が生じる。
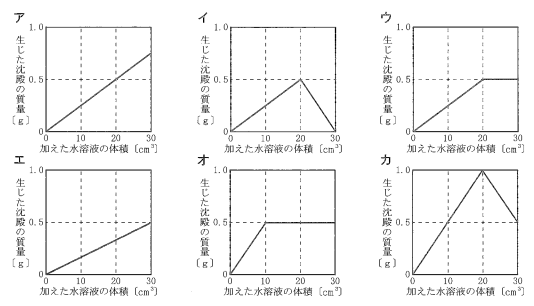
加えた水溶液が20cm³のときまで硫酸バリウムの沈殿が生じ。最大が0.5gというのを表しているのはウである。
アのグラフは沈殿が0.5g以上できているので間違い
イ、カは沈殿が減少しているので間違い
エ、オは沈殿が一定の量になる加えた水溶液の体積が20cm³でないから間違いである。
ポイント
塩酸と硫酸という違う種類の酸と水酸化バリウムの反応の実験である。
酸の種類が違っても酸は水素イオンを持っていればBTB溶液を黄色にし、水酸化バリウムのようなアルカリと反応して水素イオンを失い、中性になる。
AとBで中世に要するまでに加えた水酸化バリウムの体積が異なるのは、A、Bに含まれる水素イオンの数が
Aの水素イオンは水酸化バリウム30cm³で完全に打ち消される
Bの水素イオンは水酸化バリウム20cm³で完全に打ち消される
ということだから、Aの方がBよりも多くの水素イオンがあるということである。
水素イオンの量は反応した水酸化バリウムが30cm³は20cm³の30÷20=1.5倍なので1.5倍含まれている。
中学校では質量パーセント濃度だけを扱うので、水素イオンの数が何倍含まれているかという問題以上は出題されない。
高校レベルでは、塩酸は硫酸の何倍の個数が入っているかということを聞かれる。
硫酸の水素イオンは塩酸の1.5倍であるが硫酸は1つの分子の中に水素原子が2個、塩酸は水素原子が1つの分子の中に1つ入っているから
分子の個数では
Aの中の水素イオン:Bの中の水素イオン=3:2
Aの中の硫酸分子:Bの中の塩酸分子=1.5:2=3:4
という関係がある。高校レベルの硫酸分子の個数は塩酸分子の個数の0.75倍である。
というのは今まで聞かれてこなかった問題であるが2021年に学習指導要領が本格実施され、2021年にその前段階となる問題が北海道で出題されていることから今後出る可能性がある。