中和熱の問題と思わせておいて、熱に関することは全く出題されてない不思議な問題(2016年熊本)
実験の内容は高校レベルでも通用する実験
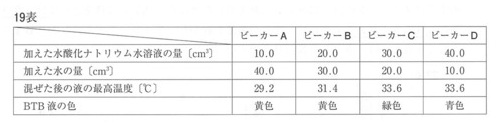
塩酸と水酸化ナトリウム水溶液を混ぜて、最高温度を測定する実験
実験III
1 うすい塩酸50.0cm³を入れたビーカーAにうすい水酸化ナトリウム水溶液10.0cm³と水40.0cm³を加え、混ぜた後の液の最高温度を測定した。
2 BTB液を数滴加え,色の 変化を調べた。
3 ビーカーB,C,Dを用意し、うすい塩酸の量はかえずに、うすい水 酸化ナトリウム水溶液の量と水の量をかえて、ビーカーAと同様の操作を行った。
4 実験に用いたうすい塩酸,うすい水酸化ナトリウム水溶液,水はすべて27.0°Cであった。
19表は、その結果を示したものである。
中和反応の定義を知っているかを問う問題
(3) 19表について、BTB 液の色から、ビーカー(1 )が中性であるとわかる。また,混ぜた後 の液の最高温度から、ビーカー(2 )で中和が起こったとわかる。
空欄1,2に当てはまるものを、次のア~オからそれぞれ一つずつ選び,記号で答えなさい。
ア A.Bだけ
ィ C,Dだけ
ゥ Cだけ
エ Dだけ
オ A~Dのすべて
酸性とアルカリ性の水溶液を混ぜて中和反応を行うとき、
中和とは酸性の水溶液中の水素イオンH⁺とアルカリ性の水溶液中の水酸化物イオンOH⁻が反応し、互いの性質を打ち消しあい、水が生じる反応である。
酸性の塩酸にアルカリ性の水溶液である水酸化ナトリウム水溶液を加えているので、温度の上昇に関係なく中和は行われている。
AとBが酸性のままなので中和が行われていない
という間違った認識をしていないかどうかを問う問題である。
また、ちょうど中性になるのを中和という。
水素イオンと水酸化物イオンが過不足なく反応したところが中和である。
ということで Cだけが中性なので中和が行われた と答えること
DはCと同じ温度だから中和が行われたと答えるのも正しくない。
答えは A~Dすべてが中和反応をしている。
イオンの数
(4) 実験IIIにおいて、混ぜた後の液に含まれる(1 )の数は、ビーカーAに対して、ビーカーB,C.Dの順に2倍,3倍,4倍となる。また、混ぜた後の液に含まれる(2 の数は、ビーカー A~Dのすべてで一定である。
空欄1,2にあてはまる適当なイオン式を入れなさい。
-
塩酸の中に水酸化ナトリウムを入れる反応である。ここでは考えやすいように
10ml中の水酸化物イオンの数を1として考える。
水素イオンはビーカーC,DではなくなることからビーカーBでは1、ビーカーAは2、何も入れていない状態では3
塩化物イオンは何も入れていない時、水素イオンと同じ量存在する、イオンとして存在し続けるので、A,B、C,Dは常に3
水酸化物イオンはA、B、Cは存在している水素イオンとすべて反応するので0
Dは1
ナトリウムイオンはAは1、Bは2、Cは3、Dは4と水酸化ナトリウム水溶液とともに上昇する。
イオンの種類と各ビーカーでのイオンの数(相対量)
|
何も入れていない |
A |
B |
C |
D |
|
|
水素イオン |
3 |
2 |
1 |
0 |
0 |
|
塩化物イオン |
3 |
3 |
3 |
3 |
3 |
|
0 |
0 |
0 |
0 |
1 |
|
|
ナトリウムイオン |
0 |
1 |
2 |
3 |
4 |
このことからAに対してイオンの数が2倍、3倍、4倍となるのは
バトリウムイオン Na⁺
イオンの数が変わらないのは
塩化物イオンCℓ⁻
ということで。この問題では温度上昇の記録は解答するのに関係ない情報である。
温度上昇に関する問題を考えてみた
ビーカーCで生成した熱は何Jか。ただし、水1.0gが1℃上昇するのに必要な熱を4.2J、生成した熱は水の温度上昇飲みに使われるものとする。
Q=質量×比熱×温度上昇より
反応後33.6℃、最初27.0℃より、温度上昇6.6℃
水の質量 100g、比熱が4.2J/(g・℃)より
ビーカーCとビーカーDで最終的な温度が同じになった理由を答えなさい。
H⁺+OH⁻→H₂O
水素イオンと水酸化物イオンが反応して水が生じるという反応が水酸化ナトリウム30mlを加えた時点で終わるから。
高校レベルではこのほかにも、温度上昇から塩酸と水酸化ナトリウム水溶液の濃度の計算まですることができる。
さらにこの水溶液の組み合わせを酸性の溶液を硫酸、アルカリ性の水溶液を水酸化バリウムとして、次のような実験を考えたらどうなるか。
発展問題を考えてみる
実験Ⅳ
1 うすい硫酸50.0cm³を入れたビーカーEにうすい水酸化バリウム水溶液10.0cm³と水40.0cm³を加え、混ぜた後の液の最高温度を測定した。
2 BTB液を数滴加え,色の 変化を調べた。
3 ビーカーF、G、Hを用意し、うすい硫酸の量はかえずに、うすい水酸化バリウム水溶液の量と水の量をかえて、ビーカーEと同様の操作を行った。
4 実験に用いたうすい硫酸と,うすい水酸化バリウム水溶液,水はすべて27.0°Cであった。
20表はこの結果を示したものである。
|
E |
F |
G |
H |
|
|
加えた水酸化バリウム水溶液(cm³) |
10 |
20 |
30 |
40 |
|
加えた水の量(cm³) |
40 |
30 |
20 |
10 |
|
混ぜた後の駅の最高温度 |
29.2 |
31.4 |
33.6 |
33.6 |
|
BTB溶液の色 |
黄色 |
黄色 |
緑色 |
青色 |
問題
この反応で沈殿として生成する物質の名称を答えなさい、
硫酸と水酸化バリウムの反応なので 硫酸バリウム 化学式で答えなさいと言われたら BaSO₄
この沈殿の色は何色か
白
20表について、BTB 液の色から、ビーカー(1 )が中性であるとわかる。また,混ぜた後 の液の最高温度から、ビーカー(2 )で中和が起こったとわかる。
空欄1,2に当てはまるものを、次のア~オからそれぞれ一つずつ選び,記号で答えなさい。
ア EFだけ
ィ G,Hだけ
ゥ Gだけ
エ Hだけ
オ E~Hのすべて
これも塩酸と水酸化ナトリウム水溶液との反応と同じでオが答えになる。
イオンの数を答える
イオンの種類と各ビーカーでのイオンの数(相対量)
|
何も入れていない |
E |
F |
G |
H |
|
|
水素イオン |
3 |
2 |
1 |
0 |
0 |
|
硫酸イオン |
3 |
2 |
1 |
0 |
0 |
|
0 |
0 |
0 |
0 |
1 |
|
|
バリウムイオン |
0 |
0 |
0 |
0 |
1 |
このような関係から、水素イオンと硫酸イオンがこの実験では同じ量存在している
EFGでは水酸化物イオンとバリウムイオンは沈殿ですべて消費される
そして、硫酸イオンとバリウムイオンが反応して硫酸バリウムが生じるときの反応熱と中和反応による中和熱と水を加えた時の溶解熱の合計がこの温度上昇のため、この実験結果から濃度の問題は出題しにくい。
ポイント
温度上昇が関係する問題では、熱量を求める問題もあると予想して問題を解く。
この熊本県の問題では、中和熱、溶解熱などの反応も考えるため、水と水酸化ナトリウムの量を合わせて50cm³になるようにしている。